- » Антропология
- » Археология
- » Архитектура
- » Астрономия
- » Библиотековедение
- » Биология
- » Биотехнологии
- » Ботаника
- » Ветеринария
- » Военные науки
- » География
- » Геология
- » Журналистика
- » За горизонтом современной науки
- » Зоология
- » Информационные технологии
- » Искусствоведение
- » История
- » Культурология
- » Лингвистика
- » Литература
- » Маркетинг
- » Математика
- » Машиностроение
- » Медицина
- » Менеджмент
- » Методика преподавания
- » Музыковедение
- » Нанотехнологии
- » Науки о Земле
- » Образование
- » Оптика
- » Педагогика
- » Политология
- » Правоведение
- » Психология
- » Регионоведение
- » Религиоведение
- » Сельское хозяйство
- » Социология
- » Спорт
- » Строительство
- » Телекоммуникации
- » Техника
- » Туризм
- » Управление и организация
- » Управление инновациями
- » Фармацевтика
- » Физика
- » Физическая культура
- » Филология
- » Философия
- » Химия
- » Экология
- » Экономика
- » Электроника
- » Электротехника
- » Юриспруденция
Особенности, оценка и лечение коронавируса (COVID-19)
ДИНАМИКА КЛИНИКО-ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ ПРИ РАБДОМИОЛИЗЕ С ОСТРЫМ ПОЧЕЧНЫМ ПОРАЖЕНИЕМ
ОЦЕНКА ИЗМЕНЕНИЙ ЛИПИДНОГО ОБМЕНА У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 2 ТИПА
Разделы: Медицина
Размещена 12.08.2019. Последняя правка: 09.08.2019.
Просмотров - 1724
ЦИТОКИНОВЫЙ И ИММУННЫЙ СТАТУС У ПАЦИЕНТОВ С РАЗЛИЧНЫМИ ФОРМАМИ ИБС (ИНФАРКТ МИОКАРДА, СТАБИЛЬНАЯ СТЕНОКАРДИЯ НАПРЯЖЕНИЯ)
Прудников Александр Руслановичмагистр медицинских наук
УО "Витебский государственный медицинский университет"
ассистент
УДК 616-005, 616-002
Цель. Изучить цитокиновый и иммунный статус у пациентов с различными формами ИБС.
Введение. На данный момент накоплено достаточно информации в пользу того, что Т-лимфоциты являются ключевыми иммунорегуляторными клетками, вовлеченными в атеросклероз [1]. Т-лимфоциты представляют собой вторую по величине популяцию клеток системы иммунитета в атеросклеротической бляшке после макрофагов [1]. Т-клетки могут влиять на атеросклероз двумя общими путями: выполняя эффекторные функции локально в артериальной стенке и влияя на клетки сосудистой стенки и другие лейкоциты, а также стимулируя Т-клеточно-зависимые B-клеточные реакции в лимфоидных органах, которые проявляются в виде ингибирования или стимулирования воспаления в сосудистой стенке с помощью циркулирующих антител [2].
Роль, которую играют B-лимфоциты в атерогенезе, на сегодняшний момент изучена в значительной степени меньше, чем роль T-лимфоцитов, однако в последние несколько лет этому элементу иммунитета уделяется все большее значение. В частности, многочисленные опыты на лабораторных крысах, которым удаляли селезёнку, показали усиление проявления атеросклероза после спленэктомии [3]. Также выявлено, что американским военнослужащим, которым выполняли спленэктомию по медицинским показаниям, риск развития ИБС был в 2 раза выше [4].
В-лимфоциты присутствуют как в здоровых, так и в пораженных атеросклерозом сосудах. Существует 2 основных семейства B-клеток: B1 и B2. По данным литературы, в процессе развития атеросклероза В1-клетки выполняют защитные функции, вырабатывая антитела (IgM) против различных липидов, в то время как В2-клетки проявляют атерогенные свойства (они синтезируют IgA, IgG, IgE) [5]. У пациентов с ИБС, уровень IgM к ок-ЛПНП имел обратную корреляцию с размерами атеросклеротической бляшки и толщиной комплекса интима-медиа в сонных артериях [6].
По данным A. Ravandi et al. (2011), в результате построения однофакторной регрессионной модели, в целом, наблюдается положительная корреляция уровней IgG, специфичных для ок-ЛПНП, с клиническими проявлениями сердечно-сосудистых заболеваний [7]. Однако данные связи теряют свою «силу» при добавлении такого фактора риска атеросклероза, как возраст, что заставляет задуматься – не является ли IgG лишь биомаркером, а не одной из «движущих сил» развития атеросклероза [7].
А. Muscari. et al. (1993) по результатам проведенных исследований пришли к выводу, что повышенный уровень IgA в сыворотке крови сочетается с наличием у пациентов инфаркта миокарда [8]. По данным, Р.Т. Kovanen et al. (1998) уровень IgA коррелируют с наличием инфаркта миокарда и летальностью от данной патологии при наличии у мужчин дислипидемии [9]. Однако исследования Z. Wang et al. (2011) по влиянию микробиома кишечника на сердечно-сосудистую систему позволяют предположить потенциально важный защитный механизм антител IgA на процесс атерогенеза [10].
Цитокины – это пептиды, которые опосредуют межклеточные взаимодействия через специфические рецепторы на клеточной поверхности [11]. Цитокины секретируются преимущественно иммунокомпетентными клетками (Т-лимфоциты, макрофаги и моноциты), но также и другими клетками (кардиомиоциты, эндотелиоциты, фибробласты и др.) организма. Цитокины подразделяются на несколько семейств: семейство интерлейкинов, последние синтезируются преимущественно клетками системы иммунитета, интерфероны (цитокины с противовирусной активностью), факторы некроза опухолей (цитокины с цитотоксической активностью), колониестимулирующие факторы, гемопоэтические цитокины [11].
Стоит отметить, что сложность иммунного ответа при атеросклерозе состоит в неоднозначности эффектов цитокинов. Они могут оказывать прямо противоположные эффекты – либо проатерогенный, либо атеропротекторный. Провоспалительными и, следовательно, проатерогенными, например, считаются фактор некроза опухоли, различные интерлейкины (ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-12, ИЛ-17, ИЛ-18) [12, 13], в свою очередь, противовоспалительными цитокинами считаются ИЛ-4, ИЛ-10, ТФР [12, 13].
Многочисленными авторами подтверждается информация о повышенной продукции цитокинов различными клетками организма как ответ на воспаление в сосудистой стенке и в атеросклеротических бляшках при развитии, например, коронарного атеросклероза. В частности, отмечается высокое содержание ИЛ-6, ИЛ-1β, а также растворимых форм рецепторов интерлейкинов – sИЛ-2R, sИЛ-6R и ФНО-α при развитии нестабильной стенокардии по сравнению с группами пациентов со стабильной стенокардией и здоровыми донорами [14]. В исследовании В.В. Кашталапа (2015) лишь СРБ, ИЛ-8, ИЛ-12 и ФНО-α сохраняли статистически значимые взаимосвязи с количеством пораженных коронарных артерий. Однако СРБ часто является неинформативным показателем, особенно при наличии гепатита, васкулита или сепсиса в анамнезе [15].
По данным С.А. Бернса и соавт. (2010) множественность поражения коронарных артерий сочетается с изменением концентрации цитокинов. Так, при однососудистом поражении максимальные значения принимают противовоспалительные цитокины ИЛ-4 и ИЛ-10, при трехсосудистом поражении – соответственно, провоспалительные цитокины (ИЛ-6, ИЛ-8, СРБ), а их максимальные значения отмечаются при деструкции атеросклеротической бляшки. Соответственно, большая степень поражения коронарных сосудов увеличивает объём поражения миокарда и увеличивает риск развития повторных неблагоприятных сердечно-сосудистых событий [16].
К настоящему моменту проведено значительное количество исследований по изучению уровней цитокинов при остром коронарном синдроме, данные которых говорят об увеличении концентрации ФНО-α, ИЛ-1, ИЛ-6, ИЛ-10 [17]. В частности, в исследовании Л.Н. Слатовой (2017) была доказана целесообразность использования ИЛ-6, ИЛ-1 и ФНО-α в качестве маркеров данного процесса по сравнению с определением тропонинов и МВ-КФК, которые дают ложноположительную информацию на стадии ишемии (т.е. при отсутствии признаков повреждения – нестабильной стенокардии, миокардитах, перикардитах, сепсисе, сердечной недостаточности, ТЭЛА и т.д.), и определением ЭКГ – при наличии на кардиограмме рубцовых изменений и/или блокады левой ножки пучка Гиса [18]. Это доказывает важность определения этих показателей на ранних этапах развития острого коронарного синдрома, т.е. в период клинических проявлений нестабильности атеросклеротической бляшки [18]. Однако не всеми учеными подтверждается это наблюдение. Исследователи приводят абсолютно разные данные по изменению цитокинового статуса в динамике острого коронарного синдрома: закономерное постепенное снижение цитокинов по мере стабилизации состояния пациента [17], а также тенденция к повышению цитокинов на 3-7-е сутки заболевания [17]. Некоторые авторы отмечают значимое снижение цитокинов на 3-7-й день, с последующим повышением их к 21-му дню наблюдения после развития острого коронарного синдрома [17].
Значительный вклад цитокинов в развитие атеросклероза послужил основой для выделения такого понятия как «мультифокальная» ранимость атеросклеротической бляшки. В качестве «распространителей нестабильности» выделяются следующие цитокины: ИЛ-6, ИЛ-18, СРБ, и ФНО-α. Они могут способствовать развитию сосудистого воспаления на значительном удалении от нестабильной бляшки и, соответственно, повышать риск развития атерогенеза и атеротромбоза других сосудистых регионов [19]. В частности, у пациентов с острым коронарным синдромом или со стабильной стенокардией, которые были включены в исследование ATHEROREMO-IVUS, повышенный уровень ФНО-α сочетался с распространенным атеросклеротическим поражением симптом-несвязанных артерий [20].
Необходимо подчеркнуть, что среди вышеперечисленных цитокинов нет какого-либо единственного, уникального, который вносил бы решающий вклад в качестве фактора риска развития сердечно-сосудистой патологии, и, ингибируя который мы могли бы предотвратить дальнейшее развитие атеросклероза (например, с помощью «точечной» иммунотерапии) [21]. Стоит отметить, что уровень циркулирующих цитокинов не обязательно отражает их действительную активность, все же различные воспалительные плазменные маркеры могут выступать как предсказатели будущего кардиоваскулярного риска. Это означает, что определение большого числа разнонаправленных цитокинов в сочетании с другими показателями, не отражающими, собственно, субклиническое воспаление, сможет стать основой для создания новых прогностических моделей развития неблагоприятных сердечно-сосудистых событий.
Например, выявлена положительная слабая корреляционная связь между баллами по шкалам CADILLAC и СРБ, ИЛ-8; GRACE и ИЛ-12; РАМI и ИЛ-12, СРБ. Такие слабые связи, возможно, объясняются участием цитокинов в формировании отдаленных неблагоприятных последствий за счет поддержания воспаления низкой интенсивности в тех или иных сосудистых регионах у пациентов с инфарктом миокарда [22]. В работе М.В. Зыков и соавт. (2012) создана прогностическая модель стратификации риска смерти, повторного инфаркта миокарда и сердечно-сосудистых катастроф в целом у пациентов, перенесших острый коронарный синдром с подъёмом ST. Данная модель учитывает результаты цветного дуплексного сканирования сонных артерий, а также концентрации ИЛ-1α, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ФНО-α для оценки развития отдалённых кардиальных осложнений [23].
Материалы и методы исследования. Исследования было одобрено локальным этическим комитетом. Все пациенты, включенные в исследование, заполнили и подписали добровольное информированное согласие на участие в работе. Были обследованы пациенты с верифицированным после проведения коронарографии и тредмил-теста диагнозом ИБС: стабильная стенокардия напряжения (ССН) 2 ФК (n=52) и пациенты с острым коронарным синдромом и с подъемом сегмента ST (n=23), которым в дальнейшем был выставлен диагноз ИБС: инфаркт миокарда (ИМ) с указанием локализации и тяжести. Контрольную группа (КГ) составили практически здоровые люди, проходившие периодический профилактический медицинский осмотр в клинике ВГМУ (n=26). Клиническая характеристика пациентов, принимавших участие в исследовании, отражена в таблице 1.
|
Показатели / Группа пациентов |
ИМ, n =24 Mе (Lq-Uq) |
ССН, n=52 Mе (Lq-Uq) |
КГ, n =26 Mе (Lq-Uq) |
p |
|
Возраст, лет |
57,1 (50,5-60,5) |
57 (52-64) |
47 (39-53) |
р1-2=0,554 р1-3=0,056 р2-3=0,059 |
|
Индекс массы тела, кг/м2 |
25,26 (24,69-27,21) |
25,61 (24,48-28,37) |
24,97 (23,66-25,51) |
р1-2=0,543 р1-3=0,073 р2-3=0,07 |
|
Длительность стенокардии, лет |
0,5 (0,3-1,0) |
3,0 (1,0-6,0) |
- |
р1-2=0,002 |
|
Длительность артериальной гипертензии (АГ), лет |
2,0 (1,0-5,0) |
3,0 (1,0-8,0) |
- |
р1-2=0,107 |
|
Наличие АГ, n (%) |
10 (43,4) |
20 (38,4) |
- |
р1-2=0,635 |
|
Курение в анамнезе, n (%) |
4 (17,4) |
6 (11,5) |
- |
р1-2=0,693 |
|
Отягощенная наследственность, n (%) |
10 (43,4) |
21 (40,4) |
- |
р1-2=0,38 |
|
Наличие сердечной недостаточности 1-2 степени, n (%) |
22 (95,6) |
47 (90,3) |
- |
р1-2=0,593 |
Длительность стенокардии в группе пациентов с ССН составила 3 (Lq-Uq, 1,0-6,0) года. В свою очередь, в группе пациентов с ИМ длительность заболевания составила 0,5 (Lq-Uq, 0,3-1,0) лет. Данные статистически различаются между собой по длительности заболевания (р=0,002). При этом у 78 % пациентов (n=18) с ИМ преходящая стенокардия отсутствовала до коронарного события или пациенты не обращались за медицинской помощью по поводу данной проблемы. У 30,7 % пациентов (n=16) с ССН отмечается в анамнезе перенесенный ИМ, в группе пациентов с ИМ коронарное событие случилось с ними впервые (р<0,001).
В группе с ИМ у 4 пациентов (17,4%) выявлено курение в анамнезе и у 4 пациентов обнаружена АГ 1 степени (17,4%), у 6 пациентов обнаружена АГ 2 степени (26,1%). В группе с ССН у 6 пациентов (11,5%) выявлено курение в анамнезе и у 10 пациентов обнаружена АГ 1 степени (19,2%) и у 10 пациентов АГ 2 степени (19,2%). Пациенты обеих групп по наличию курения в анамнезе (р=0,693) и АГ (р=0,635) статистически значимо не различались между собой.
Тяжесть сердечной недостаточности определялась согласно функциональной классификации хронической сердечной недостаточности Нью-Йоркской ассоциации кардиологов. Сердечная недостаточность 1 степени выявлена у 27 пациентов в группе с ССН (51,9%) и у 22 пациентов с ИМ (95,6%), 2 степени у 20 пациентов в группе пациентов с ССН (38,4 %) и у 1 пациента в группе ИМ (4,4%). У 3 пациентов (5,75%) с ССН сердечная недостаточность не обнаружена. По наличию группы статистически значимо не различались (р=0,593).
Пациентам с ИМ были выставлены следующие диагнозы: 8 пациентам (35.8%) не-Q ИМ левого желудочка переднее-перегородчатой области, 15 пациентам (65,2%) Q-ИМ левого желудочка (10 пациентам – ИМ нижней стенки, 4 пациентам – ИМ переднее-перегородчатой области, 1 пациенту – ИМ заднее-базальных отделов). Все ИМ относились к 1 типу – спонтанному ИМ.
Лечение пациентов с ИМ проводилось согласно клиническому протоколу диагностики и лечения острого коронарного синдрома с и без подъёма сегмента ST, нестабильной стенокардии (Приложение 2 к постановлению Министерства здравоохранения Республики Беларусь 06.06. 2017 № 59). Лечение пациентов с ССН проводилось согласно национальным рекомендаций диагностики и лечения стабильной стенокардии (Минск, 2010) и рекомендаций РНПЦ «Кардиология» по диагностике и лечению стабильной ишемической болезни в схемах и таблицах (Минск, 2017).
Не включались в исследование пациенты моложе 30 и старше 70 лет, а также при наличии следующих патологий:
– верифицированные онкологические, гематологические и воспалительные заболевания;
– острые и прогрессирующие заболевания печени и почек;
– обострение язвенной болезни желудка и двенадцатиперстной кишки;
– хроническая венозная недостаточность с тромбозами и тромбофлебитами;
– заболевания щитовидной железы с клиническими проявлениями;
– системные заболевания соединительной ткани;
Забор крови для получения сыворотки производили после 12-часового голодания утром из локтевой вены в 1-е сутки госпитализации и на 12-14 сутки госпитализации у пациентов с инфарктом миокарда. Кровь центрифугировали при 10000 оборотов/минуту 10-15 мин. Полученную сыворотку хранили в морозильной камере при -20°С не более 30 дней до проведения исследования.
Определение активности интерлейкина 4 (ИЛ-4), интерлейкина-6 (ИЛ-6), интерлейкина-8 (ИЛ-8), интерлейкина-10 (ИЛ-10), интерлейкина-18 (ИЛ-18), фактора некроза опухолей альфа (ФНО-α), сосудистой адгезионной молекулы sVCAM-1 проводилось на базе научно-исследовательской лаборатории УО «ВГМУ», согласно инструкциям по применению производителей цитокинов (компания Вектор-Бест (РФ) и Cloud-CloneCorp.(США) для sVCAM-1). Оценка показателей системы иммунитета (Т- и В- клеточный иммунитет, IgА, G, M, фагоцитарное число, фагоцитарный индекс, ЦИК) проводилась согласно общепринятой методике (Д.К. Новиков, 2000, В.Я Янченко, 2003).
Статистическая обработка результатов проводилась с помощью пакета прикладных программ Statistica 10.0, Medcalc 15.8.
Результаты. Цитокиновый статус, протеолитическая активность и содержание адгезионной молекулы sVCAM-1 представлены в таблице 2.
|
Группа пациентов/ параметр |
Инфаркт миокарда (n=23) Ме;LQ-UQ |
Стабильная стенокардия (n=52) Ме;LQ-UQ |
Контрольная группа (n=26) Me;LQ-UQ |
Р |
|
ИЛ-4, нг/л |
0,63; 0,43-1,16 |
0,67; 0,53-0,82 |
0,53; 0,29-0,82 |
р1-2=0,636 р1-3=0,109 р2-3=0,217 |
|
ИЛ-6, нг/л |
8,54; 4,78-18,924 |
1,41; 0,97-8,61 |
1,03; 0,21-1,79 |
р1-2=0,011 р1-3<0,001 р2-3=0,038 |
|
ИЛ-8, нг/л |
18,824; 8,95-66,05 |
10,802; 7,22-14,2 |
10,123; 9,07-13,7 |
р1-2=0,02 р1-3=0,047 р2-3=0,427 |
|
ИЛ-10, нг/л |
2,74; 2,19-5,39 |
2,74; 2,26-3,97 |
3,25; 1,78-5,41 |
р1-2=0,439 р1-3=0,688 р2-3=0,689 |
|
ИЛ-18, нг/л |
194,81; 129,56-320 |
228,23; 196,41-259 |
221,33; 179,96-322,9 |
р1-2=0,430 р1-3= 0,259 р2-3=0,866 |
|
ФНО-α, нг/л |
13,423; 7,01-38,955 |
7,76; 5-14,182 |
8,45; 7,37-12,17 |
р1-2=0,029 р1-3=0,109 р2-3=0,322 |
|
sVCAM-1, нг/л |
44,919; 29,86-68,29 |
30,85; 22,93-40,124 |
36,79; 27,125-46,92 |
р1-2=0,031 р1-3=0,217 р2-3=0,184 |
По данным таблицы мы можем наблюдать статистически значимые различия в изучаемых группах только для ИЛ-6, ИЛ-8, ФНО-α, sVCAM-1. В соответствии с базой данных Jenselab [24], в которой представлена информация о взаимосвязях различных белков с той или иной патологией, доказана связь ФНО-α, ИЛ-6, ИЛ-8, sVCAM-1 c развитием атеросклероза и сердечно-сосудистой патологией (Z-level 6,1; 6,9; 5,0; 7,0 соответственно), что согласуется с полученными данными.
На рисунке 1 представлены данные о статистически достоверных взаимосвязях между изучаемыми параметрами.

Рисунок 1 – Статистически значимые взаимосвязи между изученными параметрами
Наибольшее количество статистически значимых взаимосвязей отмечено в группе пациентов с ИМ, в самой группе на центральное место в развитии патологии выделен ФНО-α, однако множество других цитокинов также имеют многочисленные связи друг с другом, что создает своеобразную иммунологическую сеть. В данной сети, которая осуществляет межклеточные взаимодействия, каждый из её элементов может являться потенциальным прогностическим маркером развития острой сердечно-сосудистой патологии.
Изучив базу данных STRING [25], где отражена информация об известных и предсказанных белок-белковых взаимосвязях, была составлена схема взаимодействий изученных параметров (рисунок 2).
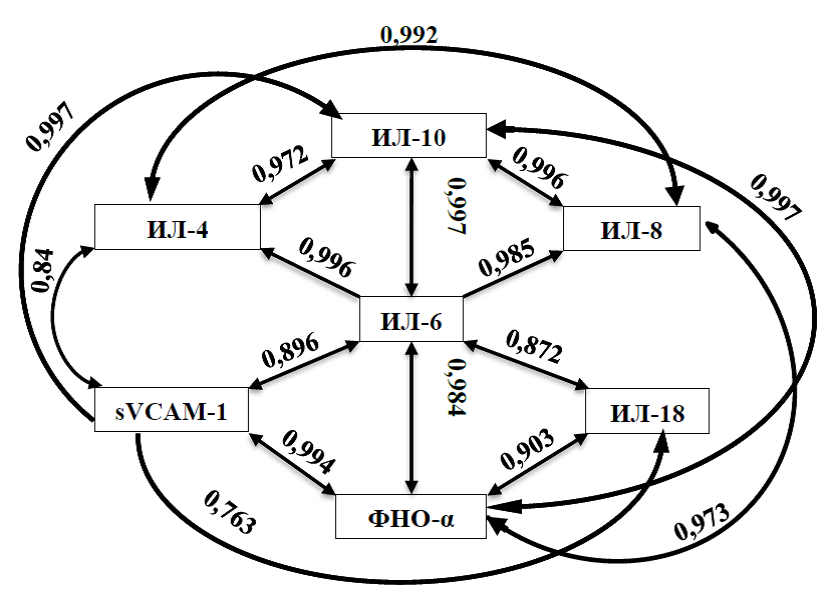
Рисунок 2 – Белок-белковые взаимосвязи между различными цитокинами согласно базе данных STRING
Представленная информация практически полностью согласуется с полученными данными, что подтверждает гипотезу об отсутствии какого-то ключевого единственного цитокина в регулировании воспалительного процесса от его начала и до конца репаративных процессов, а также представления иммунологической сети как главного «контролера» этого процесса. С другой стороны, можно выделить группу цитокинов, которая в зависимости от ситуации направляет воспалительный процесс в ту или иную сторону, например, одна из наиболее тесных взаимосвязей в базе данных представлена между ИЛ-6 и ИЛ-10.
У группы пациентов с ИМ на 12-14 сутки был повторно определен обозначенный ранее перечень цитокинов. Результаты представлены на рисунке 3.
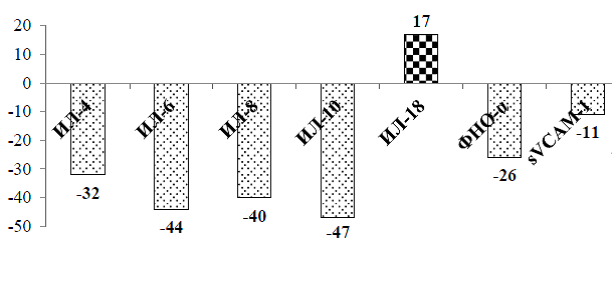
Рисунок 3 –Изменение уровня цитокинов, sVCAM-1 у пациентов с ИМ на 12-14 сутки по сравнению с 1 сутками госпитализации, %
По данным рисунка 3 наблюдается в целом однонаправленная динамика, свидетельствующая о снижении активности большинства показателей, однако статистически значимые результаты были получены только для ИЛ-6 (р=0,017), ИЛ-10 (р<0,001).
Далее определяли показатели иммунного статуса в изучаемых группах (количество Т- и В-лимфоцитов, концентрация иммуноглобулинов A, M, G и др.) Результаты представлены в таблице 3.
|
Параметр/группа |
Инфаркт миокарда (n=23) Ме;LQ-UQ |
Стабильная стенокардия (n=52) Ме;LQ-UQ |
Контрольная группа (n=26) Me;LQ-UQ |
р |
|
Т-лимфоциты общие, % |
48; 43-49 |
44; 41-48 |
58,3; 56-60,7 |
р1-2=0,293 р1-3<0,001 р2-3<0,001 |
|
В-лимфоциты, % |
16; 14-20 |
21; 18-24 |
13,27; 11,31-15,23 |
р1-2=0,001 р1-3<0,001 р2-3<0,001 |
|
Ig A, г/л |
1,99; 1,6-2,7 |
2,4; 1,9-2,9 |
1,59; 1,35-1,83 |
р1-2=0,304 р1-3<0,001 р2-3<0,001 |
|
Ig M, г/л |
0,73; 0,51-1 |
0,85; 0,51-1,46 |
1,74; 1,42-2,06 |
р1-2=0,315 р1-3<0,001 р2-3<0,001 |
|
Ig G, г/л |
9,53; 8,25-11,09 |
10,13; 9,52-11,02 |
13,66; 10,93-16,39 |
р1-2=0,441 р1-3=0,017 р2-3<0,001 |
|
ЦИК Циркулирующие иммунные комплексы (ЦИК), ед. |
71; 60-97 |
65; 52-82 |
49,3; 34,76-63,84 |
р1-2=0,19 р1-3<0,001 р2-3<0,001 |
|
Фагоцитарный индекс, % |
73; 65-84 |
71; 62-80 |
71,49; 69,46-73,52 |
р1-2=0,87 р1-3=0,907 р2-3=0,932 |
|
Фагоцитарное число, ед. |
8,2; 7,4-10 |
8,7; 7,5-10,4 |
8,5; 7,5-9,8 |
р1-2=0,85 р1-3=0,122 р2-3=0,194 |
У пациентов с различным течением ИБС были статистически значимо повышены по сравнению с КГ следующие показатели: ЦИК, концентрация IgA, В-лимфоциты. Также были снижены следующие показатели: Т-лимфоциты общие, IgM, IgG. По полученным результатам отмечается угнетение Т-клеточного иммунитета легкой степени тяжести, что, скорее всего, связано как с выраженным стрессовым воздействием возникшей патологии, так и наличием уже депрессии иммунитета у пациентов со стабильным течением ИБС. Увеличение количества В-лимфоцитов мы связываем с постоянной антигенной стимуляцией системы иммунитета, которая усиливается при повреждении той или иной сосудистой области и миокарда, а также с компенсаторным усилением именно этой части иммунитета, ввиду депрессии Т-клеточного компонента. Подтверждением данной информации является увеличение концентрации IgA, одной из функций которого является осуществление локального гуморального иммунитета.
Помимо реакции антиген-антитело у иммуноглобулинов обнаружена абзимная (ферментативная) активность [26], при этом данная активность более выражена у IgА. Возможно, это связано с тем, что при помощи абзимов организм пытается элиминировать фрагменты разрушенных структур сосудов и миокарда без участия обычных протеолитических ферментов, повреждающих эти структуры.
В группе пациентов с ИМ иммунный статус был определен повторно спустя 2 недели после начала госпитализации (рисунок 4).
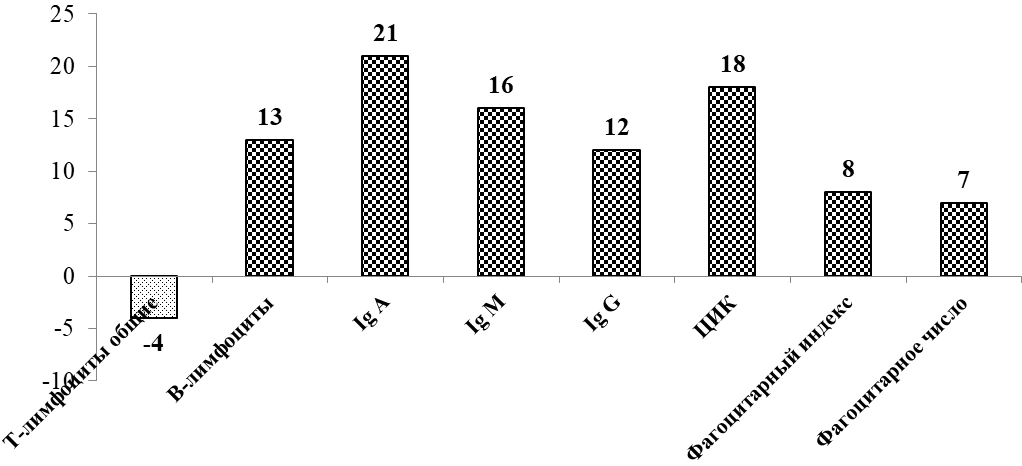
Рисунок 4 – Изменение иммунного статуса на 12-14 сутки по сравнению с 1 сутками госпитализации, %
По данным таблицы мы можем наблюдать, что в группе пациентов с ИМ при повторном заборе крови спустя 12-14 дней увеличивалась только концентрация всех исследуемых иммуноглобулинов (Ig A, р=0,014; Ig M, р= 0,012; Ig G, р=0,03), В-лимфоцитов (р=0,04), что подтверждает протективное значение гуморального иммунитета, и имелась тенденция к увеличению иммунных комплексов (р=0,765). Повышенное содержание ЦИК отражает угнетение иммунитета – происходит поддержание активности сосудистого воспаления, а тенденция к увеличению количества этих комплексов с течением времени говорит о долговременности этих изменений.
В таблице 4 приведены данные о статистически значимых корреляционных взаимосвязях между показателями цитокинового и иммунного статусов.
Таблица 4 – Статистически достоверные корреляционные взаимосвязи между показателями цитокинового и иммунного статусов
|
Параметр/Группа пациентов |
ССН |
ИМ |
|
ИЛ-6 – фагоцитарный индекс |
-0,495 |
- |
|
ФНО-α – ЦИК |
- |
0,463 |
|
ИЛ-10 – В-лимфоциты |
0,494 |
- |
|
sVCAM-1 – IgM |
-0,515 |
- |
|
sVCAM-1 – IgG |
-0,643 |
- |
|
ИЛ-8/ИЛ-10 – В-лимфоциты |
-0,504 |
- |
|
ИЛ-6/ИЛ-10 – фагоцитарный индекс |
-0,454 |
- |
Исходя из данных таблицы можно констатировать, что существуют определенные взаимосвязи между различными компонентами системы иммунитета, объясняющие вышепредставленные полученные результаты. Так, в группе пациентов с ИМ отмечается положительная связь средней силы между ФНО-α, который является одним из главных инициаторов и генераторов развития воспаления, и ЦИК, которое это воспаление поддерживает и увеличивает его продолжительность.
Одной из функций ИЛ-10 является активация В-клеточного иммунитета, защита от апоптоза В-лимфоцитов и совместно с ИЛ-4 – стимуляция синтеза различных иммуноглобулинов (кроме IgE), что подтверждается полученной положительной корреляционной связью средней силы между ИЛ-10 и В-лимфоцитами у пациентов с ССН. Также мы можем видеть обратное взаимодействие между концентрацией молекулы клеточной адгезии sVCAM-1 и концентрацией IgM и IgG, а также между индексом ИЛ8/ИЛ10 и В-лимфоцитами, что может интерпретироваться как ограничение воспаления (например, снижение привлечения клеток системы иммунитета и, соответственно, инфильтрации ими сосудистой стенки) той или иной сосудистой области и/или участка поврежденного миокарда.
Обратное взаимодействие ИЛ-6, ИЛ-6/ИЛ-10 и фагоцитарного индекса мы предполагаем, связано с тем, что ИЛ-6 изначально стимулирует развитие воспаления, а, соответственно, и активность фагоцитоза, с течением времени его концентрация снижается (это наблюдается по данных рисунка 3 у пациентов с ИМ), однако протективная активность клеточного иммунитета сохраняется, ввиду незавершенности репаративных процессов в сосудах и миокарде.
ИЛ-6, по данным литературы, является плейотропным цитокином, то есть обладающим двойственным действием по отношению к воспалительному процессу, и совместно с ИЛ-10 оказывает регулирующее воздействие на локальное воспаление сосудов и миокарда, в том числе стимулируя В-клеточный иммунитет и синтез иммуноглобулинов, не давая развиваться генерализованному воспалению с чрезмерным повреждением структур сосудов и миокарда.
По литературным данным отмечается важное значение определения индекса соотношения различных цитокинов с противоположной (про- и противовоспалительной) активностью (ИЛ-8/ИЛ-10, ИЛ-18/ИЛ-10, ИЛ-6/ИЛ-10) для определения выраженности воспалительного процесса и дальнейшей тактики лечения пациентов. Значение этих индексов в изучаемых группах приведены в таблице 5.
Таблица 5 – Соотношения различных цитокинов в изучаемых группах
|
Параметр/Группа пациентов |
Инфаркт миокарда (n=23) Ме;LQ-UQ |
Стабильная стенокардия (n=52) Ме;LQ-UQ |
Контрольная группа (n=26) Me;LQ-UQ |
р |
|
ИЛ6-ИЛ10 |
2,89; 1,18-3,85 |
0,82; 0,22-2,45 |
0,15; 0,04-0,73 |
р1-2=0,035 р1-3=0,024 р2-3<0,001 |
|
ИЛ8-ИЛ10 |
4,12; 3,25-10,49 |
3,62; 2,65-6,71 |
5,17; 2,26-7,93 |
р1-2=0,282 р1-3= 0,087 р2-3=0,493 |
|
ИЛ18-ИЛ10 |
61,21; 21,52-88,87 |
91,23; 63,76-106,88 |
92,68; 34,15-162,53 |
р1-2=0,073 р1-3=0,156 р2-3=0,969 |
По данным таблицы наблюдается единственное соотношение, являющееся статистически значимыми для всех изучаемых групп – ИЛ-6/ИЛ-10. Данный показатель был также определен в группе ИМ спустя 14 суток. Он оказался 2,31 (1,08-3,65, р=0,01), что значимо ниже значения, определенного в первые сутки. Это говорит о снижении интенсивности воспалительного процесса, но, с другой стороны, и о незавершенности репаративных процессов в сосудах и миокарде, т.к. индекс был значимо выше, чем у пациентов со стабильным течением ИБС и КГ.
По данным литературы ИЛ-6/ИЛ-10 отражен как показатель выраженности воспалительного процесса на доклинических стадиях и демонстрирующий наличие дисфункции локальной иммунной защиты. Поэтому мы предлагаем соотношение ИЛ-6/ИЛ-10 рассматривать как кардиоваскулярный индекс, отражающий не только активность воспалительного процесса, но и показывающий возможности репаративного восстановления поврежденных структур сосудов и миокарда у пациентов с ИБС, а также эффективность назначенного лечения. Ни у одного из пациентов с ИМ не развилась сердечная недостаточность 3-4 степени; им была оказана своевременная медицинская помощь (в течение первых 3-6 ч антитромботическая хирургическая и терапевтическая и антиагрегантная терапия (аспирин и/или клопидогрель)), что положительно влияет на достаточные возможности компонентов системы иммунитет по включению репаративных процессов в сосудах и миокарде.
В таблице 6 приведены данные о статистически значимых взаимосвязях между показателями цитокинового, иммунного статусов и другими рутинными клинико-лабораторными показателями, определенных у изучаемых пациентов с ИБС
Таблица 6 – Корреляционные взаимосвязи между показателями цитокинового, иммунного статусов и другими рутинными клинико-лабораторными показателями
|
Показатель/Группа пациентов |
ИМ |
ССН |
|
IgM – наличие курения в анамнезе |
0,717 |
- |
|
Индекс массы тела – ИЛ-10 |
- 0,437 |
- |
|
ИЛ-8 – Конечно-систолический объем |
0,508 |
- |
|
ИЛ-8 – конечно-диастолический объем |
0,552 |
- |
|
ИЛ-4 – ударный объем |
-0,661 |
- |
|
sVCAM-1 – наследственная отягощенность |
0,474 |
- |
|
В-лимфоциты – фракция выброса |
-0,533 |
- |
|
В-лимфоциты – толщина межжелудочковой перегородки в диастолу |
-0,510 |
- |
|
sVCAM-1 – возраст пациентов |
- |
-0,606 |
|
sVCAM-1 – количество лет со стенокардией |
- |
0,603 |
|
ИЛ-18 – толщина задней стенки в систолу |
|
0,655 |
Исходя из полученных данных можно сделать вывод о тесной взаимосвязи системы иммунитета с рутинными клинико-лабораторными показателями, отражающими состояние пациентов с ИБС. Так, по данным таблицы В-клеточный иммунитет и ИЛ-4 принимает участие в позитивном контроле сократимости миокарда, IgM – в элиминации антигенов, поступающих с табачным дымом; концентрация ИЛ-10 значительно уменьшается под действием факторов (в том числе и провоспалительных цитокинов) вырабатываемых жировой тканью у пациентов с избыточной массой тела; ИЛ-8, ИЛ-18 отрицательно влияют на сократимость миокарда, sVCAM-1 отражает влияние классических факторов риска ИБС на развитие заболевания.
Выводы. 1. Содержание ИЛ-6, ИЛ-8, ФНО-α, sVCAM-1 в сыворотке крови статистически значимо различается в изучаемых группах, что, наряду с информацией базы данных Jenselab, доказывает их участие в развитии атеросклероза и сердечно-сосудистой патологии.
2. У пациентов с ИБС отмечается угнетение Т-клеточного иммунитета и компенсаторное усиление В-клеточного иммунитета с увеличением продукции IgA, который обладая максимальной абзимной активностью среди других иммуноглобулинов, вероятно, пытается элиминировать фрагменты разрушенных структур сосудов и миокарда без участия обычных протеолитических ферментов, повреждающих эти структуры.
3. С течением времени в группе пациентов с ИМ происходит усиление протективного влияния гуморального иммунитета, ввиду увеличения количества В-лимфоцитов и содержания иммуноглобулинов класса A, M, G.
4. Полученные взаимосвязи цитокинов между собой и между компонентами иммунного статуса определяют ИЛ-6 совместно с ИЛ-10 как одну из определяющих групп регуляторов воспалительного процесса.
5. Соотношение ИЛ-6/ИЛ-10 можно рассматривать как кардиоваскулярный индекс, отражающий не только активность воспалительного процесса, но и показывающий возможности репаративного восстановления поврежденных структур сосудов и миокарда у пациентов с ИБС, а также эффективность назначенного лечения.
6. Существуют корреляционные взаимосвязи средней силы показателей системы иммунитета с рутинными клинико-лабораторными показателями, отражающими состояние пациентов с ИБС.
1. Hansson, G.K. Detection of activated T lymphocytes in the Human Atherosclerotic Plaque / G.K. Hansson, J. Holm, J. Jonasson // Amer. J. Pathol. – 1989. – Vol. 135. – Р. 169–175.
2. Targeting B Cells in Atherosclerosis Closing the Gap From Bench to Bedside / D. Tsiantoulas [et al.] // Arteriosclerosis, Thrombosis, and Vascular Biology. – 2014. – Vol. 35. – P. 296–302.
3. Protective immunity against atherosclerosis carried by B cells of hypercholesterolemic mice / G. Caligiuri [et al.] //J Clin Invest. – 2002. – Vol.109. – P. 745–753.
4. Robinette, C.D. Splenectomy and subsequent mortality in veterans of the 1939-45 war / C.D. Robinette, J.F. Jr Fraumeni // Lancet. – 1977. –Vol. 2. – P. 127–129.
5. Immunoglobulin M is required for protection against atherosclerosis in low-density lipoprotein receptor-deficient mice / M.J. Lewis [et al.] // Circulation. – 2009. – Vol. 120. – P. 417–426.
6. Immunoglobulin M type of autoantibodies to oxidized low-density lipoprotein has an inverse relation to carotid artery atherosclerosis / J. Karvonen [et al.] // Circulation. –2003. – Vol. 108. – P. 2107–2112.
7. Relationship of IgG and IgM autoantibodies and immune complexes to oxidized LDL with markers of oxidation and inflammation and cardiovascular events: results from the EPIC-Norfolk Study / A. Ravandi [et al.] // J. Lipid Res. – 2011. – Vol. 52. – P. 1829–1833.
8. Increased serum IgA levels in subjects with previous myocardial infarction or other major ischemic events / A. Muscari [et al.] // Cardiology. – 1993. – Vol. 83. – P. 383–389.
9. Prediction of myocardial infarction in dyslipidemic men by elevated levels of immunoglobulin classes A, E, and G, but not M / P.T. Kovanen [et al.] //Arch Intern Med. – 1998. – Vol. 158. – P.1434–1439.
10. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease / Z. Wang [et al.] // Nature. –2011. – Vol. 472. – P. 57–63.
11. Long-term prognosis of patients with peripheral arterial disease with or without polyvascular atherosclerotic disease / J.P. Kuijk [et al.] // European heart journal. – 2009. – Vol. 32, № 11. – P. 992–999.
12. Симбирцев, А.С. Цитокины: классифик4ация и биологические функции / А.С. Симбирцев // Цитокины и воспаление. – 2004. – Том 3, № 2. – С. 16–23.
13. Прудников, А.Р. Роль цитокинов в диагностике нестабильности атеросклеротической бляшки / А.Р. Прудников, А.Н. Щупакова // Вестник ВГМУ. – 2018. – Том 17, № 5. – С. 28–42.
14. Gori, A.M. Increased cytokine prodaction in ischaemic heart disease patients / A.M. Gori, T. Brunelli, G. Peope // Eur. Heart J. – 1998. – Vol. 19. – P. 506.
15. Прогрессирование мультифокального атеросклероза после инфаркта миокарда / М.В. Зыков [и др.] // Кардиология и сердечно-сосудистая хирургия. – 2013. – № 3. – С. 23–28.
16. Клиническая и прогностическая значимость мультифокального атеросклероза у больных с острым коронарным синдромом без подъема сегмента ST / С.А. Бернс [и др.] / Кардиология. – 2012. – № 7. – С. 4–8.
17. Динамика воспалительного процесса у больных с острым коронарным синдромом и больных со стабильной стенокардией. Биохимические и иммунологические аспекты / В.В. Кухарчук [и др.] // Кардиологический вестник. – 2007. – Том 2, № 2. – С. 48–55.
18. Слатова, Л.Н. Значение маркеров субклинического воспаления, эндотелиальной дисфункции и фиброза миокарда в оценке прогноза у пациентов с инфарктом миокарда / Л.Н. Слатова, Е.Я Бойцова // Материалы V Всероссийской конференции «Противоречия современной кардиологии: спорные и нерешенные вопросы» (21-22 октября 2016 года), Самара, 2016. – С. 109–110.
19. Ишемическая болезнь сердца / О.П. Шевченко [и др.]. – М.: Реафарм, 2005. – 416 с.
20. Circulating cytokines in relation to the extent and composition of coronary atherosclerosis: results from the ATHEROREMO-IVUS study / L.C. Battes // Atherosclerosis. – 2014. – № 23. – Р. 18–24.
21. Болевич, С.Б. Молекулярные механизмы в патологии человека: руководство для врачей / С.Б. Болевич, В.А. Войнов. – М.: МИА, 2012. – 208 с.
22. Tedgui, A. Cytokines in atherosclerosis: pathogenic and regulatory pathways / A. Tedgui, Z. Mallat // Physiol Rev. – 2006. –Vol. 86. – P. 515–581.
23. Использование биомаркеров-цитокинов в диагностике и прогнозировании течения инфаркта миокарда: методические рекомендации для врачей-кардиологов / М.В. Зыков [и др.] – Кемерово, 2012. – 24 с.
24. База данных Cellular Network Biology // Режим доступа: https://jenselab.org. – Дата доступа: 25.05.2019.
25. STRING – база данных и веб-ресурс для поиска информации об известных и предсказанных белок-белковых взаимодействиях // Режим доступа: https://string-db.org/help.pl?sessionId=XfBLZ72gcJ6B. – Дата доступа: 25.05.2019.
26. Генералов, И.И. Абзимная активность иммуноглобулинов: [монография] / И.И. Генералов // Министерство здравоохранения Республики Беларусь. – Витебск: [ВГМУ], 2000. – 151 с.
Рецензии:
13.09.2019, 20:11 Манин Константин Владимирович
Рецензия: Данная статья написана хорошим медицинским языком и рекомендуется к публикации в журнале.
С наилучшими пожеланиями к.б.н. Манин К.В.
Комментарии пользователей:
Оставить комментарий
Вверх