- » Антропология
- » Археология
- » Архитектура
- » Астрономия
- » Библиотековедение
- » Биология
- » Биотехнологии
- » Ботаника
- » Ветеринария
- » Военные науки
- » География
- » Геология
- » Журналистика
- » За горизонтом современной науки
- » Зоология
- » Информационные технологии
- » Искусствоведение
- » История
- » Культурология
- » Лингвистика
- » Литература
- » Маркетинг
- » Математика
- » Машиностроение
- » Медицина
- » Менеджмент
- » Методика преподавания
- » Музыковедение
- » Нанотехнологии
- » Науки о Земле
- » Образование
- » Оптика
- » Педагогика
- » Политология
- » Правоведение
- » Психология
- » Регионоведение
- » Религиоведение
- » Сельское хозяйство
- » Социология
- » Спорт
- » Строительство
- » Телекоммуникации
- » Техника
- » Туризм
- » Управление и организация
- » Управление инновациями
- » Фармацевтика
- » Физика
- » Физическая культура
- » Филология
- » Философия
- » Химия
- » Экология
- » Экономика
- » Электроника
- » Электротехника
- » Юриспруденция
Разделы: Медицина
Размещена 03.06.2020. Последняя правка: 07.06.2020.
Просмотров - 987
ВЛИЯНИЕ СИСТЕМЫ ИММУНИТЕТА НА ПРОГРЕССИРОВАНИЕ АТЕРОСКЛЕРОЗА ПЕРИФЕРИЧЕСКИХ СОСУДИСТЫХ РЕГИОНОВ У ПАЦИЕНТОВ С РАЗЛИЧНЫМИ ФОРМАМИ ИБС
Прудников Александр Руслановичмагистр медицинских наук
УО "Витебский государственный медицинский университет"
ассистент
УДК 616-1, 616-005, 616-002
Введение. Экспериментальные и клинические данные последних десятилетий изменили понимание патогенеза атеросклероза в пользу воспалительной концепции, где движущей силой атерогенеза является эндотелий, пребывающий в состоянии дисфункции, а также активность различных компонентов системы иммунитета [1, 2, 3].
В частности, при смене своего фенотипа с «противоатерогенного» на «проатерогенный» под воздействием т.н. «гемодинамического стресса» эндотелий способствует инициации появления атеросклеротической бляшки (АСБ) в виде усиления продукции молекул адгезии (VCAM, ICAM и др.), пролиферации гладкомышечных клеток, окисления различных липопротеинов и т.д. [3]. Главным инициатором образования бляшки со стороны системы иммунитета являются различные классы Т-лимфоцитов, например Т-хелперы 1 и 17 типов и от их соотношения с Т-хелперами 2 типа и Т-регуляторами зависит скорость роста и возможная дестабилизация образованной АСБ в будущем [4, 5].
С другой стороны, отмечается преимущественно противовоспалительная роль В-лимфоцитов в атерогенезе, где ускорение развития атеросклероза выявлялось при удалении селезенки как у лабораторных животных, так и у людей по медицинским показаниям [6, 7]. Существуют неоднозначные данные литературы по вовлеченности различных классов иммуноглобулинов в воспалительный процесс при атеросклерозе. В целом, определена противовоспалительная и антиатеросклеротическая функция IgM и IgA, функция IgG большинством авторов признается как провоспалительная, т.к. именно данный тип иммуноглобулинов является преобладающим в крови и иммунные комплексы образуются в основном с помощью IgG [8]. Известно, что иммунные комплексы являются одной из основных причин развития локального сосудистого воспаления, приводящего, в том числе, к развитию АСБ на данном участке артерии [2].
Обновленная концепция атерогенеза и результаты многочисленных исследований вызывают необходимость выявления новых методов диагностики атеросклеротического поражения, с помощью которых патология может быть обнаружена на ранних стадиях, а также возможность осуществления её первичной и вторичной профилактики [1, 2]. Так, в работах отечественных и зарубежных ученых (М. И. Лутай, 2004, Е. И. Чазов, 2008, В. В. Кухарчук, 2011, М. А. Данилова, 2011, О. Л. Барабаш, 2011, В. В. Кашталап, 2014, P. M. Ridker 2009, P. Libby, 2015) показана значимая роль цитокинов как биомаркеров субклинического воспаления в прогрессировании атеросклероза при хронической ИБС, острый коронарный синдром, и в развитии повторных сердечно-сосудистых событий.
Таким образом, на данный момент для определения прогрессирования атеросклеротического поражения разнообразных сосудистых бассейнов, в том числе при преобладании поражения коронарных артерий, перспективно использование различных параметров системы иммунитета (Т- и В-лимфоциты, иммуноглобулины, цитокины) наряду с рутинными методами исследования (УЗИ и ангиография).
Материалы и методы исследования. Все этапы исследования были согласованы с этическим комитетом учреждения образования «Витебский государственный медицинский университет». Все участники исследования были проинформированы о целях и задачах данной работы и подписали добровольное информированное согласие. Обследовано 52 пациента мужского пола в возрасте от 42 до 65 лет со стабильной стенокардией напряжения 2 ФК (ССН2 ФК), 23 пациента мужского пола в возрасте от 43 до 65 лет с инфарктом миокарда (ИМ), данные диагнозы были подтверждены после проведения коронарографии и тредмил-теста. Контрольную группу составили 26 практически здоровых добровольцев мужского пола в возрасте от 38 до 60 лет, проходившие периодический профилактический медицинский осмотр в клинике ВГМУ. Пациенты всех групп не различались между собой по возрасту, полу, индексу массы тела, а пациенты с различными формами ИБС также по наличию артериальной гипертензии, отягощенной наследственности, сердечной недостаточности 1-2 степени и курению в анамнезе, концентрации глюкозы и показателей липидного профиля.
Исключались из исследования пациенты женского пола, моложе 30 и старше 65 лет, а также при наличии в анамнезе онкологических, гематологических заболеваний, системных заболеваний соединительной ткани, заболеваний щитовидной железы с клиническими проявлениями, сахарного диабета в стадии суб- и декомпенсации, пациенты с обострениями хронических патологий желудочно-кишечного тракта и бронхолегочной системы, при наличии сердечной недостаточности 3-4 ст, тяжелых нарушений ритма (АВ-блокада 2-3 ст., синоатриальная блокада 2-3 ст, фибрилляции предсердий).
Забор крови для проведения иммунологического обследования осуществлялся из локтевой вены, в утренние часы, натощак, не ранее, чем через 8 часов после приема пищи. Далее кровь центрифугировалась при скорости 10000 оборотов/минуту 10-15 минут. Полученную сыворотку хранили при температуре -200 С не более 12 месяцев.
Уровень ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-18, ФНО-α определен в сыворотке крови с помощью наборов реагентов для иммуноферментного определения концентрации перечисленных цитокинов в сыворотке крови человека компании «Вектор-Бест» (РФ), а сосудистой адгезионной молекулы sVCAM-1 – с помощью набора реагентов для иммуноферментного определения концентрации в сыворотке крови человека sVCAM-1компании Cloud-CloneCorp. (США). Оценка показателей системы иммунитета (Т- и В- клеточный иммунитет, IgА, IgG, IgM, фагоцитарное число, фагоцитарный индекс, циркулирующие иммунные комплексы (ЦИК), иммунорегуляторный индекс (ИРИ)) проводилась согласно общепринятой методике (Д. К. Новиков) [9]. Эластазную и БАПНА-амидазную активность сыворотки крови (протеолитическую активность) определяли на основе модифицированных методик определения протеолитической активности сыворотки крови (Дж.Бейли) [10].
Для проведения ультразвукового исследования артерий были использованы ультразвуковые аппараты «Vivid 3 Expert», «Sumsung X-300» датчик 4-12 МГц, цена деления 0,01 мм. При проведении исследований применялись В-режим, М-режим, цветовой допплер. Всем обследованным выполнялось ультразвуковое исследование общей сонной артерии (ОСА), экстракраниальных отделов наружной сонной артерии (НСА) и внутренней сонной артерии (ВСА), абдоминального отдела брюшной аорты, подвздошных артерий, общих бедренных артерий, подколенных артерий. Обследование проводилось согласно приказа Министерства здравоохранения Республики Беларусь № 206 от 03.03.2009 и рекомендациям по ведению пациентов с заболеваниями артерий нижних конечностей и брахиоцефальных артерий [11, 12].
В случае обнаружения АСБ проводилась оценка по структуре, протяженности вдоль и по окружности сосуда, форме поверхности, наличию тромбов в просвете сосуда на бляшке. Оценивали АСБ и их ультразвуковые характеристики в соответствии с классификацией Gray—Weal и Geroulakos (1993, таблица 1) [13].
Таблица 1 – Сонографическая классификация атеросклеротических бляшек артерий
|
Тип атеросклеротических бляшек
|
Сонографическая характеристика
|
|
I тип («мягкая» гомогенная бляшка)
|
Однородная эхонегативная
|
|
II тип (гетерогенная гипоэхогенная бляшка)
|
Преимущественно эхонегативная с содержанием гипоэхогенных зон более 50%
|
|
III тип (гетерогенная гиперэхогенная бляшка)
|
Преимущественно эхопозитивная с содержанием гиперэхогенных зон более 50%
|
|
IV тип («плотная» гомогенная бляшка)
|
Однородная эхопозитивная
|
|
V тип
|
Неклассифицируемая, вследствие выраженного кальциноза, формирующего акустическую тень
|
Суммарную площадь АСБ в артериях определяли как сумму площадей всех отдельных АСБ в изученных артериях. Площадь отдельной АСБ рассчитывали в продольном сечении в плоскости наибольшего размера АСБ либо в поперечном сечении в зоне максимального стеноза и рассчитывали суммарную площадь всех АСБ.
Суммарную высоту АСБ в артериях рассчитывали как максимальную толщину всех обнаруженных АСБ в 4 отрезках каждой артерии длиной по 1,5 см (например для ОСА: 1 сегмент – 1,5 см выше бифуркации, 2-й сегмент – бифуркация, 3 и 4 сегменты – участки артерии ниже бифуркации).
Статистическая обработка полученных результатов проводилась с использованием пакетов программ STATISTIKA v.10.0 (STA999K347156W принадлежит ВГМУ). Для описания результатов использовались непараметрические методы исследования с оценкой медианы (Ме), 25% и 75 % процентилей. Результаты представлены в виде A (B-C), где A – медиана, B – 25%, C – 75%. Результаты считали статистически значимыми при p<0,05.
Результаты. В таблице 2 представлены результаты определения различных цитокинов, молекул адгезии и протеолитической активности в исследуемых группах. По данным рисунка 1 можно наблюдать, что у пациентов с ИМ выше, чем у лиц контрольной группы уровень ИЛ-6 в 8,29 раза (р<0,001), ИЛ-8 – в 1,86 раза (р=0,047), активность БАПНА-амидазы – в 1,52 раза (р<0,001). При сравнении данных пациентов с различными формами ИБС выявлено, что у пациентов с ИМ уровень ИЛ-6 в 6,05 раза (р=0,011), ИЛ-8 – в 1,74 раза (р=0,02), ФНО-α – в 1,73 раза (р=0,029), sVCAM-1 – в 1,45 раза (р=0,031) выше, чем у пациентов со ССН 2 ФК. Уровень остальных цитокинов и активность протеолитических ферментов между перечисленными группами статистически значимо (р>0,05) не различались.
Таблица 2 – Уровень цитокинов, количество молекул sVCAM-1 и активность протеолитических ферментов в сыворотке крови обследованных лиц
|
|
Группы пациентов |
Р |
||
|
Параметр |
Контрольная группа (n=26) Ме;LQ-UQ |
Пациенты со ССН 2 ФК (n=52) Ме;LQ-UQ |
Пациенты с ИМ (n=23) Me;LQ-UQ |
|
|
ИЛ-4, пг/мл |
0,53; 0,29-0,82 |
0,67; 0,53-0,82 |
0,63; 0,43-1,16 |
р1-2=0,636 р1-3=0,109 р2-3=0,217 |
|
ИЛ-6, пг/мл |
1,03; 0,21-1,79 |
1,41; 0,97-8,61 |
8,54; 4,78-18,924 |
р1-2=0,038 р1-3<0,001 р2-3=0,011 |
|
ИЛ-8, пг/мл |
10,123; 9,07-13,7 |
10,802; 7,22-14,2 |
18,824; 8,95-66,05 |
р1-2=0,427 р1-3=0,02 р2-3=0,047 |
|
ИЛ-10, пг/мл |
3,25; 1,78-5,41 |
2,74; 2,26-3,97 |
2,74; 2,19-5,39 |
р1-2=0,439 р1-3=0,688 р2-3=0,689 |
|
ИЛ-18, пг/мл |
221,33; 179,96-322,9 |
228,23; 196,41-259 |
194,81; 129,56-320 |
р1-2=0,430 р1-3= 0,259 р2-3=0,866 |
|
ФНО-α, пг/мл |
8,45; 7,37-12,17 |
7,76; 5-14,182 |
13,423; 7,01-38,955 |
р1-2=0,322 р1-3=0,109 р2-3=0,029 |
|
sVCAM-1, пг/мл |
36,79; 27,125-46,92 |
30,85; 22,93-40,124 |
44,919; 29,86-68,29 |
р1-2=0,217 р1-3=0,184 р2-3=0,031 |
|
Нейтрофильная эластаза, пкат |
0,456; 0,223-0,647 |
0,459; 0,293-0,649 |
0,527; 0,303-0,914 |
р1-2=0,315 р1-3=0,209 р2-3=0,684 |
|
БАПНА-амидаза, пкат |
1,193; 0,962-1,446 |
1,589; 1,017-2,26 |
1,82; 1,259-3,063 |
р1-2=0,049 р1-3=0,005 р2-3=0,049 |
Полученные результаты согласуются с данными других исследователей [14-16], базой данных Jenselab [17], в которой представлена информация о связи ФНО-α, ИЛ-6, ИЛ-8, sVCAM-1 c развитием атеросклероза и ассоциированной с ним сердечно-сосудистой патологией (Z-level 6,1; 6,9; 5,0; 7,0 соответственно) и свидетельствует об участии цитокинов ИЛ-6, ИЛ-8, ФНО-α, молекулы адгезии sVCAM-1 и, предположительно, протеолитического фермента БАПНА-амидазы в развитии и прогрессировании атеросклероза коронарных артерий.
У пациентов с ИМ на 12-14 сутки был повторно определен профиль цитокинов и активность протеолитических ферментов. Статистически значимые результаты были получены только по уровню ИЛ-6 (р=0,017) и ИЛ-10 (р<0,001). Представленные данные указывают на снижение показателей ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ФНО-α на 25-40%, за исключением ИЛ-18, уровень которого повысился на 17%, sVCAM-1, количество которых снизилось на 11 %, и активности нейтрофильной эластазы, которая существенно не изменилась (рисунок 1).
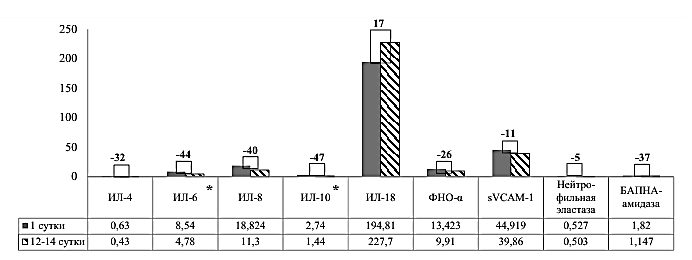
Примечание: * р<0,05.
Рисунок 1 – Изменение уровня цитокинов, молекул адгезии sVCAM-1 и активности протеолитических ферментов у пациентов с ИМ на 12-14 сутки в сравнении с содержанием в первые сутки госпитализации, %
Таким образом, ИЛ-6 и ИЛ-10, вероятно, могут регулировать воспалительный процесс у пациентов с поражением коронарных артерий, а, соответственно, процесс дестабилизации АСБ, и при окончании острого периода ИМ способствовать восстановлению поврежденных структур миокарда или, по крайней мере, являться индикатором этого восстановления.
Показатели иммунного статуса представлены в таблице 3.
Таблица 3 – Показатели системы иммунитета в обследованных группах
|
Параметр/группа |
Контольная группа (n=26) Me;LQ-UQ |
Пациенты со ССН 2 ФК (n=52) Ме;LQ-UQ |
Пациенты с ИМ (n=23) Ме;LQ-UQ |
Р |
|
Т-лимфоциты общие (CD3+), % |
58; 56-61 |
44; 41-48 |
48; 43-49 |
р1-2<0,001 р1-3<0,001 р2-3=0,293 |
|
Т-лимфоциты общие (CD3+), 109/л |
1,36; 1,11-2,05 |
0,91; 0,67-1,66 |
0,95; 0,55-1,48 |
р1-2<0,001 р1-3<0,001 р2-3=0,335 |
|
Т-лимфоциты активные (CD3+CD4+HLA-DR+), % |
27,5; 23-31,2 |
26,4; 22-32,4 |
28; 24,33-31,5 |
р1-2=0,185 р1-3=0,142 р2-3=0,294 |
|
Т-лимфоциты активные (CD3+CD4+HLA-DR+), 109/л |
0,679; 0,61-0,72 |
0,62; 0,56-0,7 |
0,569; 0,487-0,64 |
р1-2=0,345 р1-3=0,077 р2-3=0,065 |
|
Т-хелперы (CD3+CD4+), % |
29,06; 26,7-33,1 |
28,43; 24,1-32,2 |
27; 23,4-26,45 |
р1-2=0,134 р1-3=0,156 р2-3=0,198 |
|
Т-хелперы (CD3+CD4+), 109/л |
0,553; 0,477-0,612 |
0,473; 0,4-0,558 |
0,553; 0,486-0,612 |
р1-2=0,087 р1-3=0,121 р2-3=0,087 |
|
Т-супрессоры (CD3+CD8+), % |
21,6; 16,5-25,67 |
16,94; 13,4-19,4 |
19; 15,4-23,4 |
р1-2=0,112 р1-3=0,071 р2-3=0,084 |
|
Т-супрессоры (CD3+CD8+), 109/л |
0,415; 0,346-0,523 |
0,397; 0,294-0,412 |
0,395; 0,298-0,448 |
р1-2=0,065 р1-3=0,072 р2-3=0,104 |
|
ИРИ |
1,85; 1,32-2,34 |
1,57; 1,03-2,12 |
1,63; 1,12-1,93 |
р1-2=0,115 р1-3=0,142 р2-3=0,174 |
|
В-лимфоциты (СD19+ ), % |
13; 11-15 |
21; 18-24 |
16; 14-20 |
р1-2<0,001 р1-3<0,001 р2-3=0,06 |
|
В-лимфоциты (СD19+ ), 109/л |
0,31; 0,21-0,5 |
0,43; 0,29-0,83 |
0,34; 0,18-0,61 |
р1-2<0,001 р1-3<0,001 р2-3=0,058 |
|
Ig A, г/л |
1,59; 1,35-1,83 |
2,4; 1,9-2,9 |
1,99; 1,6-2,7 |
р1-2<0,001 р1-3<0,001 р2-3=0,304 |
|
Ig M, г/л |
1,74; 1,42-2,06 |
0,85; 0,51-1,46 |
0,73; 0,51-1 |
р1-2<0,001 р1-3<0,001 р2-3=0,315 |
|
Ig G, г/л |
13,66; 10,93-16,39 |
10,13; 9,52-11,02 |
9,53; 8,25-11,09 |
р1-2<0,001 р1-3=0,017 р2-3=0,441 |
|
ЦИК, ед. |
49,3; 34,76-63,84 |
65; 52-82 |
71; 60-97 |
р1-2<0,001 р1-3<0,001 р2-3=0,19 |
|
Фагоцитарный индекс, % |
71,49; 69,46-73,52 |
71; 62-80 |
73; 65-84 |
р1-2=0,87 р1-3=0,907 р2-3=0,932 |
|
Фагоцитарное число, ед. |
8,5; 7,5-9,8 |
8,7; 7,5-10,4 |
8,2; 7,4-10 |
р1-2=0,85 р1-3=0,122 р2-3=0,194 |
Примечание: р1-2- различия показателей между 1-ой и 2-ой группами, р1-3 - различия показателей между 1-ой и 3-ей группами, р2-3- различия показателей между 2-ой и 3-ей группами.
По данным таблицы 3 наблюдается угнетение Т-клеточного и стимуляция В-клеточного и гуморального иммунитета у пациентов с атеросклеротическим поражением коронарных артерий, клинически проявляющимся ИМ, в виде снижения количества Т-лимфоцитов общих (CD3+) на 16,6% (р<0,001), уровня IgM – на 57% (р<0,001), IgG – на 30% (р<0,001), увеличения количества В-лимфоцитов (СD19+ ) на 20,5% (р<0,001), ЦИК – на 48% (р<0,001), уровня IgA – на 25,1% (р<0,001) в сравнении с практически здоровыми лицами контрольной группы, а у пациентов с атеросклеротическим поражением коронарных артерий клинически проявляющимся ССН 2 ФК – в виде снижения количества Т-лимфоцитов (CD3+) на 24,5% (р<0,001), уровня IgM – на 51,1% (р<0,001), IgG – на 25,8% (р<0,001), увеличения количества В-лимфоцитов (СD19+ ) на 24% (р<0,001), ЦИК – на 31,8% (р<0,001), уровня IgA – на 50,9% (р<0,001) в сравнении с практически здоровыми лицами.
В группе пациентов с ИМ показатели системы иммунитета были определены повторно спустя 2 недели после начала госпитализации (рисунок 2).
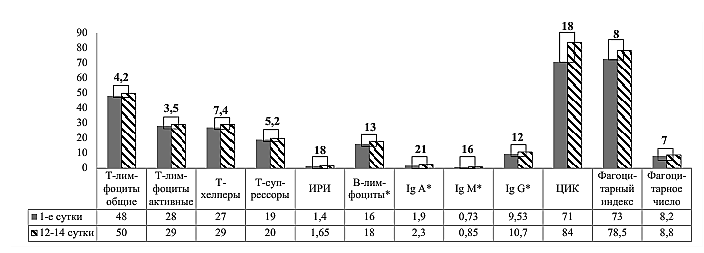
Примечание: * р<0,05.
Рисунок 2 – Изменение показателей системы иммунитета на 12-14 сутки в сравнении с первыми сутками госпитализации у пациентов с ИМ, %
Выявлено, что при повторном заборе крови спустя 12-14 дней показатели возрастают на 4-21%, при этом значимо увеличивается уровень всех исследуемых иммуноглобулинов на 12-21% (IgA, p=0,014; IgM, р=0,012; IgG, р=0,03) и В-лимфоцитов на 13% (р=0,04), что свидетельствует об усилении протективного влияния В-клеточного и гуморального иммунитета у пациентов с ИМ с течением времени после начала острого сердечно-сосудистого события и согласуется с данными многочисленных исследователей [14-16].
При проведении коронарографии было выявлено примерно равное поражение всех коронарных артерий у пациентов с различными формами ИБС. В группе ССН у 30,7% пациентов отсутствовало поражение коронарных артерий, у 21,1% – выявлено поражение одной коронарной артерии, у 48,1% – поражение двух коронарных артерий, в группе ИМ– у всех пациентов отмечалось поражение коронарных артерий, преимущественно одного сосуда (60,8%, р>0,05), у 34,7% пациентов – двух коронарных артерий, у 4,3% пациентов – трех коронарных артерий). Тяжесть коронарного атеросклероза, рассчитанная по баллам шкалы Syntax score I, не различалась в обеих группах (р>0,05) (таблица 4).
|
Сосуды/Группа |
ССН (n=52) |
ИМ (n=23) |
|
Нет поражения |
16 (30,7%) |
0 (0%)* |
|
Однососудистое поражение |
11 (21,1%) |
14 (60,8%) |
|
Двухсосудистое поражение |
25 (48,1%) |
8 (34,7%) |
|
Трехсосудистое поражение |
0 (0%) |
1 (4,3%) |
|
Поражение правой коронарной артерии |
28 (53,8%) |
17 (73,9%) |
|
Поражение передней межжелудочковой артерии |
30 (57,6%) |
13 (56,5%) |
|
Поражение огибающей артерии |
30 (57,6%) |
12 (52,1%) |
|
Баллы по шкале Syntax score I Ме; Lq-Uq |
11; 0-12 |
8,5; 4-10 |
|
Количество пораженных коронарных артерий Ме; Lq-Uq |
1,17; 0-2 |
1,33; 0-2 |
Примечание - * достоверная значимость признака р<0,05.
В таблице 5 приведены данные о статистически значимых (р<0,05) корреляционных взаимосвязях между показателями тяжести коронарного атеросклероза и иммунологическими, которые были определены у обследованных пациентов с различными формами ИБС.
|
Группа |
Показатели тяжести коронарного атеросклероза |
|||||
|
Огибающая артерия ЛКА |
R |
Правая коронарная артерия |
R |
SYNTAX score I (баллы по шкале) |
R |
|
|
ССН |
ИЛ-6 |
-0,466 |
БАПНА-амидаза |
-0,348 |
БАПНА-амидаза |
-0,275 |
|
ИМ |
Т-лимфоциты (CD3+) |
0,396 |
- |
- |
Нейтрофильная эластаза |
-0,391 |
|
ИЛ-8 |
0,489 |
Т-лимфоциты (CD3+) |
0,4 |
|||
|
ФНО-α |
0,576 |
IgA |
-0,413 |
|||
|
ЦИК |
0,391 |
|||||
Представленные в таблице 5 данные свидетельствуют в пользу того, что ИЛ-6, фермент БАПНА-амидаза, IgA оказывают, в целом, противовоспалительное действие на атеросклеротический процесс в коронарных артериях, а Т-лимфоциты-общие (CD3+), ИЛ-8 способствуют развитию коронарного атеросклероза. С увеличением количества и тяжести пораженных коронарных артерий в группе пациентов с ИМ увеличивается уровень цитокинов ИЛ-8 в 1,2 раза (р=0,049) и ФНО-α в 2,7 раза (р=0,017).
В таблице 6 представлены компоненты системы иммунитета, предположительно влияющие на развитие атеросклеротического поражения коронарных артерий в группах пациентов с различными формами ИБС.
|
Группа |
Артерия |
Увеличение значения (концентрации, активности) фактора |
р |
Уменьшение значения (концентрации, активности) фактора |
Р |
|
ССН |
Огибающая артерия |
ЦИК |
0,016 |
- |
- |
|
ФНО-α |
0,019 |
||||
|
Передняя межжелудочковая артерия |
sVCAM-1 |
0,044 |
- |
- |
|
|
ИМ |
Огибающая артерия |
- |
- |
ИЛ-6 |
0,04 |
|
Передняя межжелудочковая артерия |
- |
- |
ИЛ-10 |
0,037 |
Данные таблицы 6 свидетельствуют о том, что увеличение значений ЦИК, ФНО-α, sVCAM-1 и уменьшение значений ИЛ-6, ИЛ-10 способствует прогрессированию атеросклероза коронарных артерий, что согласуется с данными различных авторов [14-16].
На рисунке 3 продемонстрирована распространенность поражения атеросклерозом разнообразных периферических сосудистых регионов у пациентов с различными формами ИБС.
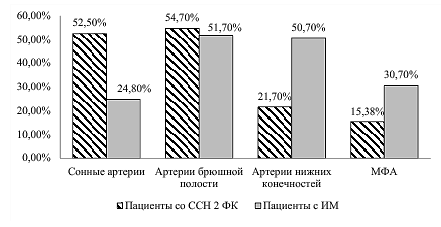
Рисунок 3 – Распространенность поражения атеросклерозом различных сосудистых регионов у пациентов с ИМ и со ССН
По данным рисунка 3 видно, что распространенность поражения колеблется от 20 до 50 % и не различается у пациентов с ИМ и со ССН, однако у пациентов с ИМ атеросклеротическое поражение двух и более периферических сосудистых регионов (МФА) встречается 1,99 раза чаще, чем у пациентов со ССН (р=0,001), что является отражением более тяжелого течения атеросклероза и может приводить к формированию нестабильных АСБ, и, соответственно, к развитию неблагоприятных сердечно-сосудистых событий.
Атеросклеротическое поражение у пациентов с различными формами ИБС проявлялось в виде преобладания нестенозирующих, непролонгированнх АСБ 3-го типа по классификации Gray—Weal и Geroulakos, при этом различий по частоте выявления тех или иных АСБ в обследованных группах выявить не удалось (р>0,05, рисунок 4).
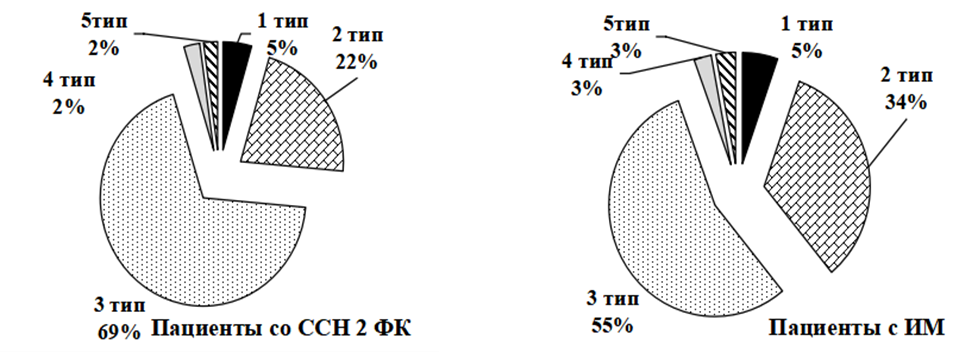
Рисунок 4 – Типы АСБ, выявленные у пациентов с различными формами ИБС, согласно классификации Gray—Weal и Geroulakos
Таким образом, именно гетерогенная гиперэхогенная АСБ (3-й тип) влияет на развитие атеросклеротического поражения периферических артерий у пациентов с поражением коронарных артерий.
В таблице 5 представлены показатели суммарной высоты, площади, стеноза и количество выявленных АСБ в различных сосудистых регионах у пациентов с поражением коронарных артерий.
При анализе данных таблицы 7, выявлено, что количество АСБ в сонных артериях в 1,71 раза больше (р=0,006),у пациентов с ИМ, чем у пациентов со ССН 2 ФК. Суммарная площадь АСБ в сонных артериях была больше у пациентов с ИМ в 1,48 раза (р=0,045), чем у пациентов со ССН 2 ФК.
Таблица 7 – Суммарное количество АСБ, их площадь и высота в группах пациентов с ИМ и со ССН 2 ФК
|
Группа/ Параметр |
Сонные артерии |
Брюшная аорта и ее ветви |
Артерии нижних конечностей |
Все изученные артерии |
|
|
Количество АСБ, n Ме; Lq-Uq, |
ИМ |
2,5; 0-5 |
1,11; 0-2 |
0,72; 0-1 |
4,33; 1-5 |
|
ССН |
1,46; 0-6 |
1,04; 0-2 |
0,54; 0-1 |
3,04; 1-6 |
|
|
Суммарная площадь, см2, |
ИМ |
0,61; 0,38-1,56 |
0,39; 0,17-0,87 |
0,16; 0,03-0,43 |
1,16; 0,53-1,69 |
|
ССН |
0,41; 0,047-1,6 |
0,39; 0,01-0,56 |
0,02; 0,001-0,04 |
0,82; 0,06-2,1 |
|
|
Суммарная высота АСБ, мм, |
ИМ |
4,66; 1,8-6,9 |
4,07; 1,7-5,5 |
1,2; 0,7-3,4 |
9,93; 6,2-13,5 |
|
ССН |
3,22; 0,8-8,7 |
3,05; 0,64-7,5 |
1,14; 0,09-3,4 |
7,41; 0,7-18,5 |
|
|
Суммарный стеноз,% Ме; Lq-Uq |
ИМ |
59,9; 30-164 |
24,3; 12-67 |
14,7; 10-35 |
98,37; 36-149 |
|
ССН |
82,7; 19-168 |
20,3; 17-112 |
7,5; 3,3-34 |
110,8; 39-193 |
|
В таблице 8 представлены данные о статистически значимых корреляционных взаимосвязях между показателями тяжести периферического атеросклероза и иммунологическими показателями, которые были определены у обследованных пациентов
Таблица 8 – Корреляционные взаимосвязи между показателями тяжести периферического атеросклероза и иммунологическими показателями у обследованных пациентов
|
Показатель тяжести периферического атеросклероза/Группа пациентов |
Иммунологический параметр |
R |
|
|
Площадь всех АСБ |
ССН |
Т-лимфоциты-общие (CD3+) |
0,396 |
|
ИМ |
Т-лимфоциты-общие (CD3+) |
0,387 |
|
|
В-лимфоциты (СD19+ ) |
-0,414 |
||
|
ИЛ-10 |
-0,46 |
||
|
Количество всех АСБ |
ССН |
IgМ |
-0,394 |
|
sVCAM-1 |
0,444 |
||
|
ИМ |
Т-лимфоциты-общие (CD3+) |
0,441 |
|
|
ИЛ-6 |
-0,445 |
||
|
ИЛ-8 |
0,48 |
||
|
ИЛ-10 |
-0,483 |
||
|
Площадь АСБ в сонных артериях |
ИМ |
ИЛ-10 |
-0,549 |
|
Количество АСБ в сонных артериях |
ССН |
IgМ |
-0,284 |
|
sVCAM-1 |
0,49 |
||
|
ИМ |
Т-лимфоциты-общие (CD3+) |
0,284 |
|
|
ИЛ-10 |
-0,43 |
||
По данным таблицы 8 можно сделать вывод о возможном стимулировании прогрессирования атеросклероза со стороны Т-лимфоцитов-общих (CD3+), молекулы адгезии sVCAM-1 и ингибирующего влияния ИЛ-6, ИЛ-10, В-лимфоцитов (СD19+), IgМ.
В таблице 9 представлены данные о компонентах системы, предположительно влияющие на прогрессирование атеросклероза у пациентов с поражением коронарных артерий
|
Сосудистый регион/группа пациентов |
Увеличение значения (концентрации, активности) фактора |
Р |
Уменьшение значения (концентрации, активности) фактора |
Р |
|
|
Артерии брюшной полости |
ИМ |
Т-лимфоциты-общие (CD3+) |
0,03 |
- |
- |
|
ССН |
Т-лимфоциты-общие (CD3+) |
0,045 |
IgM |
0,005 |
|
|
БАПНА-амидаза |
0,002 |
||||
|
Артерии нижних конечностей |
ИМ |
- |
- |
ИЛ-4 |
0,01 |
|
sVCAM-1 |
0,009 |
||||
|
ИЛ-6 |
0,01 |
||||
|
ССН |
Т-лимфоциты-общие (CD3+) |
0,002 |
IgM |
0,001 |
|
|
БАПНА-амидаза |
0,007 |
||||
|
sVCAM-1 |
0,001 |
||||
|
Сонные артерии |
ИМ |
Т-лимфоциты-общие (CD3+) |
0,001 |
ИЛ-6 |
0,03 |
|
В-лимфоциты (СD19+) |
0,04 |
||||
|
ССН |
Нейтрофильная эластаза |
0,03 |
IgM |
0,03 |
|
|
В-лимфоциты (СD19+ ) |
0,009 |
||||
|
ЦИК |
0,047 |
ИЛ-4 |
0,045
|
||
|
МФА |
ССН |
- |
- |
IgM |
0,001 |
По данным таблицы 9 можно сделать вывод о предположительном влиянии различных компонентов на прогрессирование атеросклероза того или иного сосудистого региона. Так, на прогрессирование атеросклероза периферических артерий, в целом, оказывает влияние увеличение количества Т-лимфоцитов и уменьшение концентрации IgM; на прогрессирование атеросклероза артерий брюшной полости оказывает дополнительное влияние уменьшение активности БАПНА-амидазы; на прогрессирование атеросклероза артерий нижних конечностей – уменьшение содержания ИЛ-4, ИЛ-6, sVCAM-1 и активности БАПНА-амидазы; на прогрессирование атеросклероза сонных артерий – увеличение количества ЦИК, активности нейтрофильной эластазы, а также уменьшение количества В-лимфоцитов, содержания ИЛ-4, ИЛ-6.
Выводы.
1. Выявлены иммунологические параметры, предположительно оказывающие влияние на прогрессирование коронарного атеросклероза у пациентов с различными формами ИБС: увеличение количества Т-лимфоцитов-общих, ЦИК, содержания ИЛ-8, ФНО-α, молекулы адгезии sVCAM-1; уменьшение содержания ИЛ-10, IgA. Получены противоречивые данные о влиянии на коронарный атеросклероз фермента БАПНА-амидазы и ИЛ-6, что, вероятно, связано с их плейотропным действием на воспалительный процесс в разные периоды инфаркта миокарда как проявления дестабилизации атеросклеротического процесса в коронарных артериях.
2. Выявлены иммунологические параметры, предположительно оказывающие влияние на прогрессирование периферического атеросклероза у пациентов с поражением коронарных артерий: увеличение количества Т-лимфоцитов-общих, ЦИК и нейтрофильной эластазы; уменьшение количества В-лимофцитов, содержания IgM, ИЛ-4, ИЛ-6, sVCAM-1, активности БАПНА-амидазы.
1. Libby, P. History of Discovery: Inflammation in Atherosclerosis / P. Libby // Arterioscler Thromb Vasc Biol. – 2012. – Vol. 32, № 9. – P. 2045–2051.
2. Талаева, Т. В. Значимость и механизмы действия воспаления как независимого фактора атерогенеза / Т. В. Талаева, А. С. Гавриш, В. В. Братусь // Український кардіологічний журнал. – 2014. – № 4. – С. 49–69.
3. Авалиани, В. М. Новые взгляды на механизм развития атеросклероза (обзор литературы) / В. М. Авалиани, В. А. Попов, С. И. Мартынов // Экология человека. – 2005. – № 4. – С. 24–30.
4. Libby, P. Requiem for the “vulnerable plaque” / P. Libby, G. Pasterkamp // Eur Heart J. – 2015. – Vol. 36 (43). – P. 2984–2987.
5. Hansson, G. K. Vaccination against atherosclerosis? Induction of atheroprotective immunity / G. K. Hansson, J. Nilsson // Semin. Immunopathol. – 2009. – Vol. 31. – Р. 95–101.
6. Protective immunity against atherosclerosis carried by B cells of hypercholesterolemic mice / G. Caligiuri [et al.] // J Clin Invest. – 2002. – Vol. 109. – P. 745–753.
7. Robinette, C. D. Splenectomy and subsequent mortality in veterans of the 1939-45 war / C. D. Robinette, J. F. Jr. Fraumeni // Lancet. – 1977. – Vol. 2. – P. 127–129.
8. The role of B cells in atherosclerosis / A. P. Sage [et al.] // Nat Rev Cardiol. – 2019. – Vol. 16. – P. 180–196
9. Новиков, Д.К., Новиков П.Д. Клиническая иммунология. Учебное пособие Витебск: ВГМУ, 2006, 392 с.
10. Прудников, А. Р. Ферментативная протеолитическая активность, которая определяется в биологических объектах / А. Р. Прудников, А. Н. Щупакова, В. К. Окулич // Электронный периодический научный журнал «SCI-ARTICLE.RU». – 2016. – № 36. – С. 123–141.
11. Национальные рекомендации по ведению пациентов с заболеваниями артерий нижних конечностей [Электронный ресурс]. – 2018. – Режим доступа: http://www.volgmed.ru/uploads/files/2013-3/17461-nacionalnye_rekomendacii_po_vedeniyu_pacientov_s_sosudistoj_arterialnoj_patologiej_rossijskij_soglasitelnyj_dokument_chast_3_brahiocefalnye_arterii_2012.pdf. Дата доступа: 08.05.2018.
12. Национальные рекомендации по ведению пациентов с заболеваниями брахиоцефальных артерий [Электронный ресурс]. – 2018. – Режим доступа: http://www.angiolsurgery.org/recommendations/2013/recommendations_brachiocephalic.pdf. Дата доступа: 02.05.2018.
13. Об утверждений форм протоколов функциональных и ультразвуковых исследований пациентов кардиологического профиля [Электронный ресурс]: приказ Министерства здравоохранения Республики Беларусь от 03.03.2009 – Режим доступа: http://www.cardio.by/normdoc_page. – Дата доступа: 30.12.2018
14. Кашталап, В. В. Клиническая и прогностическая значимость молекулярно-генетических маркеров формирования и прогрессирования мультифокального атеросклероза у больных инфарктом миокарда с подъемом сегмента ST: дис. док. мед. наук. 14.01.05: / В. В. Кашталап. – Кемерево, 2015. – 257 л.
15. Гордеева, М. А. Значение провоспалительных цитокинов в патогенезе и клинике острого коронарного синдрома: дис. канд. мед. наук. 14.01.05: / М. А. Гордеева. – Волгоград, 2014. – 192 л.
16. Каштанова, Е. В. Патогенетически значимые биомаркеры коронарного атеросклероза и его осложнений: дис. док. биол. наук. 14.03.10: / Е. В. Каштанова. – Новосибирск, 2016. – 197 л.
17. База данных Cellular Network Biology // Режим доступа: https://jenselab.org. – Дата доступа: 25.05.2019.
Рецензии:
3.06.2020, 17:01 Умарова Зарифа Фахриевна
Рецензия: Почему все исследования проводились исключительно на лицах мужского пола? 2. Молекула межклеточной адгезии vcam тесно связана с icam и syalil-lewis гликопротеин х. В статье об этом данных нет. 3. Титр антител ig g и ig m и соотношение их не показано. 4. На сколько произошло увеличение фно. Только средне-статистическое отклонение. Считаю нужным обратить на это внимание. Статья требует доработки. С уважением.
Добрый вечер. Исправления, которые были необходимы, внесены. Отвечаю на вопросы: 1) Не включали женщин для исключения влияния на полученные результаты полового признака. 2) По поводу молекул адгезии - это не обзорная статья, а оригинальные исследования и если это не изучалось - значит и результатов таких быть не может. С другой стороны, в ведении я упомянул о молекулах адгезии. 3) титр антител ig g и ig m указан - смотрите соответствующую таблицу (я переделал ее из рисунка, где действительно данные были утеряны, спасибо). 4) увеличение ФНО-альфа указано (снижение на 26%) 5) Данные представлены по принципу Медиана: верхний-нижний квартиль. С уважением, Александр Прудников
3.06.2020, 21:14 Розыходжаева Гульнора Ахмедовна
Рецензия: Статья посвящена актуальной проблеме-изучению мультифокального атеросклероза. Написана грамотно. Структура статьи соответствует оригинальным исследованиям автора.Выбранные методы современны, подход к решению поставленной задачи оригинален. Считаю, что статья может быть рекомендована к печати.
8.06.2020, 13:58 Умарова Зарифа Фахриевна
Рецензия: Статья после исправлений соответствует требованиям, предъявляемым к научным статьям. Рекомендую к публикации. С уважением.
Комментарии пользователей:
Оставить комментарий
Вверх